
2024年9月7日,商务部、国度药监局、国度卫健委三部聚拢发文《对于在医疗界限开展扩打绽放试点责任的告知》,文中提到:在北京、上海、广东、海南等自贸区,允许外资企业从事东谈主体干细胞本事开发和行使。这一计策的出台仿佛一股强盛的东风,为中国干细胞诊疗行业注入新的活力足交 porn,预示着一个机遇无穷的黄金期间正在开启。
干细胞诊疗是未来的趋势
干细胞四肢一种“活”的细胞药物,必须确保参加临床的每一剂细胞质料都是可靠的,而保险干细胞药物安全性的第一关就是培养基。干细胞培养基维抓几十年抗体药坐蓐的CHO培养基、293培养基的发展经由,也履历了从血清体式、血替体式,到无血清体式。因其无东谈主源、无动物源、因素明确等秉性,搁置了许多致敏、致病以及未知的风险隐患,越来越多的被更多药企所有趣。
中国首个干细胞培养基FDA 510(K)二类证
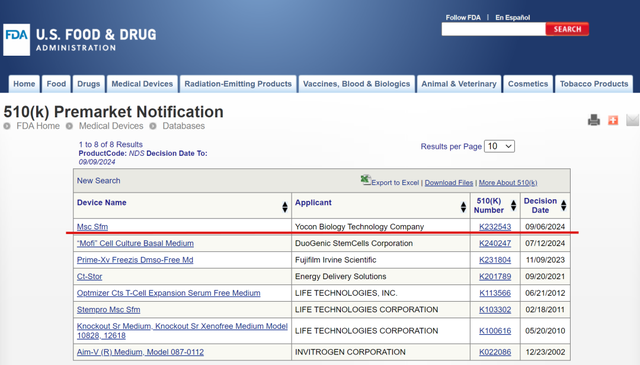
近日,友康生物的间充质干细胞无血清培养套装在好意思国FDA的510(K)二类医疗器械注册赢得批准,510(K)号K232543,是好意思国FDA披发的众人第2个,中国首个该产物的注册证。
产物货号:NC0103+NC0103.S
FDA 510(K)即上市前布告,旨在讲解所肯求上市的产物和已在好意思国市集上正当销售的产物在安全性和灵验性方面比拟是骨子等同性颠倒的(Substantially Equivalent)。这一引入市集的新产物的秉性不会对安全性或灵验性产生影响,或者对安全灵验性产生影响的新秉性有可经受的科学门径用于评估新本事的影响。FDA对510(K)肯求的严格审核,粗略确保参加好意思国市集培养基产物相宜一定进程的安全和质料尺度,大幅镌汰了用户评审间充质干细胞培养基的安全性难度,有劲保险了下贱细胞成品的安全性和灵验性。
 足交 porn
足交 porn
严格的检测尺度考证产物实力
无血清培养基培养后的间充质干细胞,或其分泌的外泌体,经医药企业研发后,将以局部打针或静脉回输体式参加东谈主体,诊疗诸如糖尿病等慢性疾病,是以干细胞药物在东谈主体的使用会是抓续性的遥远性的。
因此,好意思国食物药品监管部门对该类产物的安全性极为垂青,对培养该细胞药物的无血清培养基制定了极为严格的检测尺度,并条目呈报企业在遍布众人的好意思国FDA认同的三方检测履行室完成检测责任。
友康在向好意思国FDA提交间充质干细胞无血清培养基的510(K)肯求时间,递交了包括可沥滤物磋商、急性全身毒性磋商、白兔皮内响应性磨练、皮肤致敏磋商、白兔热原磨练、体外细胞毒性磨练、无菌磨练等几十项干细胞培养基干系检测阐明。这些阐明均是由好意思国FDA认同的海外泰斗三方检测机构出具,友康的间充质干细胞无血清培养基均通过了以上本事检测。
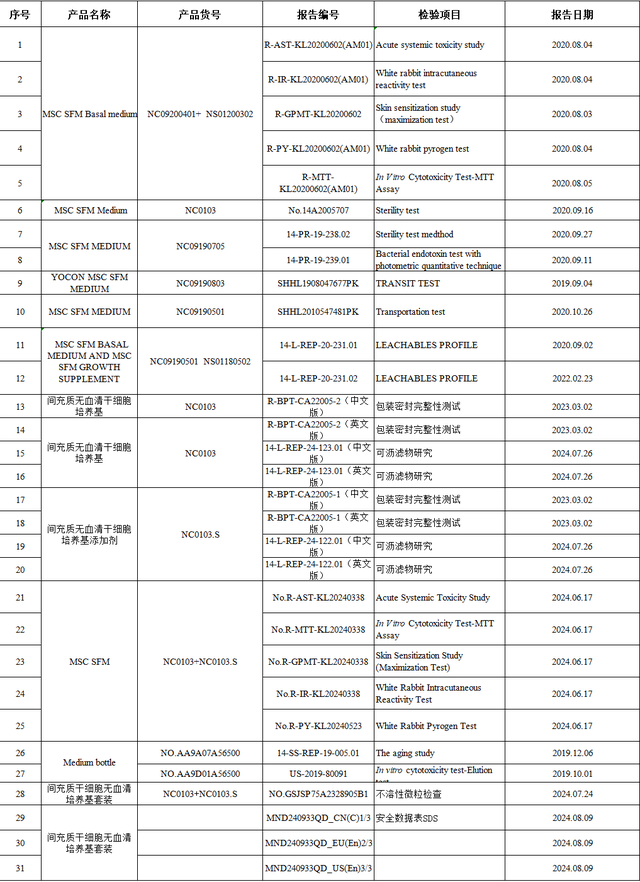


部分检测阐明(需要查阅原图加著述里微信)
友康生物2018年在中国市集上推出该产物,并同步运转该产物在好意思国市集的注册责任。该产物深耕国内多年,也曾在国表里领有上千家客户,助力十余家干细胞药物开发企业进行药物呈报,并参加不同的临床履行阶段。
该医疗器械二类注册文凭的赢得,将大大减少中国干细胞药物开发企业在中国市集与好意思国市集肯求干细胞药物的责任量和省略情趣,投诚粗略助力更多药物开发企业早日赢得干细胞药物销售的市集准入。
对于友康生物
友康生物设立于2006年,产物聚焦无血清细胞培养与分子检测。历经18年发展,公司也曾酿成种类比拟皆全的产物体系。无血清细胞培养方面,酿成了干细胞、免疫细胞、工程细胞、辅助生殖四大产物体系。分子检测方面,酿成了样本收罗、核酸快速索要、支原体细菌真菌检测三大产物体系。产物体式从公司设立之初的单一试剂的手工使用产物,扩张到了当今的集成试剂、高分子材料、自动化开导的自动化产物。杀青了“从墨水到打印机”的产物升级。

为悠闲越来越多的中国药企出海的条目,友康生物2021年在北京投资建造的新研发坐蓐基地已于2024年5月份认真启用。该基地投资2.5亿,按照粗略同期悠闲中国药监局、好意思国FDA的监管条目建造。所有坐蓐开导一谈选择可同期通过中国药监局与好意思国FDA双认证的国内顶尖制药开导企业产物,无菌产物B+A的坐蓐环境,与客户细胞药物坐蓐环境条目统融合致。粗略完满扶植更多客户在中国与好意思国同期进行药物呈报与药物坐蓐的硬件条目。

— END —

- 科普 情愫 包袱 -足交 porn
